澳大利亚的抗凝治疗
介绍
抗凝治疗适用于很多患者的各种适应证[1-5]。例如维生素K拮抗药(VKAs),如华法林,仍是最长应用的口服抗凝药物之一,其广泛用于:静脉血栓的治疗,包括深静脉血栓(DVT)和肺栓塞(PE),房颤(AF)患者的卒中预防,减少假性心脏瓣膜雪霜形成和血栓栓塞的风险[1-3,6]。不论是普通肝素(UH)还是低分子量肝素(LMWH),都是最常用的抗凝药物的代表,即使都是胃肠外用药(静脉或皮下应用)[1-4,6]。最近凝血酶(因子IIa)或因子Xa (FXa)的直接抑制药的应用彻底改变了口服抗凝疗法的面貌,并产生了“直接口服抗凝药”的概念(DOACs)[1-3,5,6]。本篇叙述性综述中,我们简要概述澳大利亚现有的抗凝药物的优缺点,以及与抗凝治疗相关的一些变化。
肝素抗凝治疗
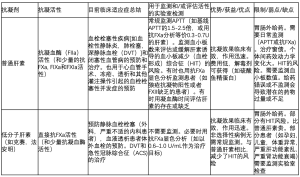
如上所述,肝素疗法有很多不同的选择,广泛使用的有UF、LMWH,一些病例也使用直接或间接抑制凝血酶(FIIa)or FXa的肝素类或肝素样分子。肝素疗法的主要优缺点见表1。
主要的优势是治疗费用低,起效迅速,临床疗效好,如果过量或因出血、急症手术需要逆转的情况下,可以随时提供解毒剂(至少应对普通肝素来说)。
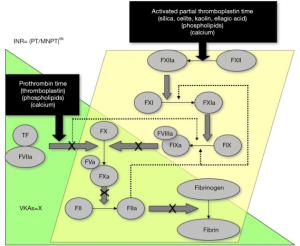
肝素疗法受限于需要静脉内或皮下给药才能获得抗凝疗效。或常规(每天1-2次)或持续输注(UH),既不方便,也不受欢迎。肝素疗法需要实验室监测,要么使用活化的部分凝血酶原时间(APTT)分析(针对UH),要么使用抗FXa 显色分析(LMWH,部分对UH)(表1,图1,图2),增加了抗凝疗法的费用和复杂性。基于对试剂敏感性的有限评估或不一致性[4],在检测和临床效果之间要选择一个有效的肝素治疗范围。常常需要监测血小板数值,肝素诱导的血小板减少症(HIT)虽然只发生在少部分人身上,但临床意义很明显,可能有严重的临床后遗症,如血栓或器官损害[7,8]。这就是被熟知的病理性HIT或伴有栓塞的HIT,简称为HITT。
VKA抗凝疗法
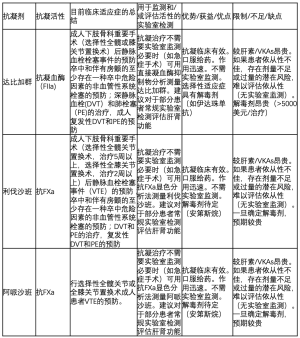
使用华法林这类的VKAs治疗同样具有优点和缺点(表2)。VKAs是价格低廉、临床有效的抗凝药代表,口服给药。如果药物过量或需要逆转治疗(如急症手术)可以获得解毒剂。
VKAs受限于起效慢,个体间对抗凝药的反应差异较大,与很多药物和食物有交叉反应。这些限制必须使用另一种药物(常为肝素)作为起始治疗,并定期监测实验室指标,最典型的是使用凝血酶原时间(PT),转化为国际正常比率(INR)。这造成了很多问题(不方便,不愿意,很耗时),不仅仅是需要常规静脉穿刺取血。INR是由实验室检测PT值计算而来,也存在包括准确性有限等一些问题[9-11]。
DOACs
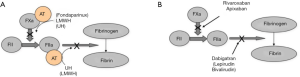
虽然肝素和VKAs这类抗凝药物临床有效,但它的局限性推动了抗凝治疗不断的发展,最近发布了直接作用于FIIa 或FXa的抑制药,和目前广为周知的DOACs,这些药物包括达比加群(抗FIIa)和澳大利亚的阿哌沙班及利伐沙班(都是抗FXa药物)。此外DOACs在其他国家也能获得,包括依度沙班和贝曲沙班(都是抗FXa药物)。DOACs的临床适应证与肝素和/或VKAs相似,也与另一种药物相似(表3)。不同国家的适应证也许有所不通,取决于当地的监管部门许可。
从优势来说,DOACs类已经被证明有效且安全,有研究显示DOACs与对照组具有相似或更优的效果[12-14]。已经开发并上市了不需要常规检测的DOACs类药物,比经典的抗凝药物更加方便。检测只在必要时进行[5,15]。在处置急性手术或致命性出血时可以使用伊达珠单抗逆转达比加群[16];但是因子Xa抑制药的特异性解毒剂在澳大利亚还处于临床试验阶段,不能购买到。
从缺点来看,DOACs比肝素或VKAs更贵,虽然成本效益数据提示使用DOACs对卫生系统来说间接的节省了成本(如减少了出血也就减少了住院,而且不需要常规实验室监测)。由于不需要常规的实验室监测,因此存在过量或剂量不足的潜在风险,相应的也分别增加了出血或栓塞的风险,特别是对那些依从性差或有并发症的患者来说。事实上DOACs的依从性是一个大问题——漏服VKAs可以作调整,而漏服DOACs则会导致12-24小时的抗凝覆盖时间。另外,如果患者出现了漏服,下一次应该服用双倍剂量,但又造成了高风险的出血事件。虽然DOACs的解毒剂很方便获得,但相对于使用肝素和VKA的患者来说费用是很贵的。虽然抗凝治疗不需要日常监测,但需要对肝肾功能(监测合适的参数)进行风险评估,在此情况下,药物蓄积导致出血的风险增加。
其他抗凝药物
在澳大利亚,其他的一些抗凝药物适应证广泛,总结在表4[2]。这些药物在医院内的适应证受到相当大的限制,并没有在社区内广泛使用,它们需要严密的监测,使用起来也相对昂贵(图2,表4)。
Full table
讨论
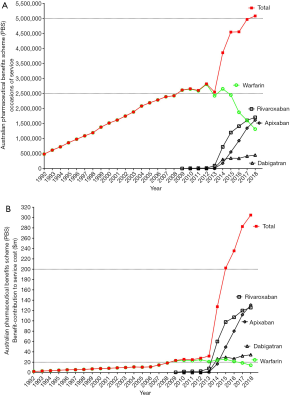
因为获益显著,临床医生开的DOACs处方和患者使用量正在增加,实际上澳大利亚当地的处方数据表明DOACs已经取代了VKA疗法成为最常见的抗凝处方药物(图3)。相对于华法林处方量的持续减少,DOACs处方量稳定增加,最明显的就是抗活化因子X(FXa)药物(利伐沙班和阿哌沙班)。利伐沙班和阿哌沙班较达比加群优先使用抗-FXa药物,部分原因与澳大利亚的机构有关——达比加群没有获得政府对治疗DVT/PE的补贴。数据显示,在收集期内全部口服抗凝药物(华法林,阿哌沙班,利伐沙班和达比加群)的处方数量实际上在增加,然而对数据的直接对比存在一些限制,因为每种药物的处方数和使用形式都不存在类似性(如华法林片剂规格有1毫克,2毫克,3毫克和5毫克,利伐沙班片剂规格有10毫克,15毫克和20毫克)。但是发现的证据显示DOACs不仅仅是取代华法林,用于抗凝患者初治的处方数量也一直在增加;另一种可能因素是随着抗-FXa 药物剂量的减少,更多的患者不需要长期预防VTE。这些数据没有提供处方的更多确证或适应性的细节,即使DOACs的风险/获益比明显优于VKAs,对于以前不适用VKA的部分患者,临床医生可以更早的开始抗凝治疗,或者将使用减量预防使用抗-FXa药物的抗凝治疗下延长时间甚至无限期用药。
重要的是,适应证症清单与更长的禁忌证清单之间需要作平衡,口服抗凝药禁忌证总结于表5。虽然被认为是安全的药物,但为每一个个体患者开具处方时都要考虑相关风险。
基于脚本数据的分析显示,另一个限制使胃肠外制剂主要在医院内使用,因此社区使用的脚本不多见。这与DOAC使用取代了肝素,特别是依诺肝素等LWMHs的使用有关。
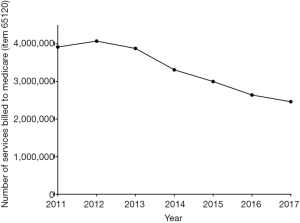
外地工作者和卫生实践的关系正在改变抗凝医疗的成本和和抗凝病理检测的潜在效果,包括实验室监测抗凝治疗。对于后者而言,例如VKA治疗的实验室监测是病理实验室的关键性活动,PT/INR是最常做的抗凝试验,在血液学中可能仅次于全血细胞计数。APTT是另一个常做的凝血试验,有时用于肝素治疗的监测。来源于医疗保险和2011-2017期间的数据显示PT/INR和APTT的检测数量在下降,如图4所示。在澳大利亚这个试验需求的下降趋势是与VKA使用的减少相一致并与抗凝检测相关的[6]。
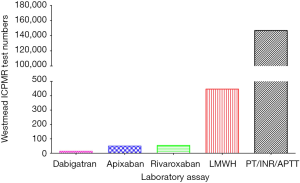
PT/INR/APTT实验室监测没有被增长的DOAC检测所取代,我们医院总的需求<200/年,而LMWH的抗-Xa 检测将近500,PT/INRs/APTTs 检测超过70,000(图5)。DOAC测量试验,不像PT/INRs/APTTs ,没有吸引澳大利亚的医疗保险基金,也就不能从我们熟悉的政府网站获得检测数量的国家数据。
最后需要考虑的是DOACs使用的增加对血液学实验室检测的影响,这也是实际面临的问题。例如,虽然我们测量的DOACs药物水平每年<200例,但同一时期对服用DOACs药物的活跃患者审核发现有超过2000例的常规凝血检测[6],超过了特殊DOACs测量分析的20倍,至少这些患者的非预期常规检测的增加提升了临床关注度。为了分析异常检测结果,可以根据反应进一步检验(如因子分析)。与易栓倾向的有关要求是不适合服用DOACs患者的,可能引起一系列问题,包括先天性缺陷的误认或者狼疮抗凝物的鉴别错误[5,7-12]。
讨论
DOACs的使用不论是在澳大利亚还是世界范围内都保持持续增长,替代了部分VKA治疗,替代了部分LMWH治疗,和用于治疗部分潜在的新患者(以前不需要抗凝或扩展到预防继发性VTE)。预计这种趋势仍会持续,部分原因是由于预期寿命增加,随着年龄的增加,血栓前状态的风险也会增加(如VTE,AF)。实验室检测根据这些情况的改变也在变化中,PT/INR/APTT检测数量在减少,有时需要测量DOACs,与DOAC使用相关的并发症实验室检测和止血试验,及很多分析法的效应。若没有认识到DOAC其他止血分析法的试验结果的影响,将导致疾病误诊的潜在风险增高。世界范围内的血液学实验室需要意识到这些对检测服务的主动管理事件的重要性。我们察觉澳大利亚的情况并不是唯一的,希望其他地方的实验室能够在本期杂志中分享经验。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the editorial office, Annals of Blood for the series “Anticoagulant and antithrombotic therapy: globally applied according to local geographical selection criteria”. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aob.2018.12.02). The series “Anticoagulant and antithrombotic therapy: globally applied according to local geographical selection criteria” was commissioned by the editorial office without any funding or sponsorship. EJF served as an unpaid Guest Editor of the series. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the manuscript and ensure that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Disclaimer: The opinions expressed in this review are those of the authors, and not necessarily those of NSW Health Pathology.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Favaloro EJ. Anticoagulant therapy: present and future. Semin Thromb Hemost 2015;41:109-12. [Crossref] [PubMed]
- Favaloro EJ, Lippi G, Koutts J. Laboratory testing of anticoagulants - the present and the future. Pathology 2011;43:682-92. [Crossref] [PubMed]
- Lip GYH, Banerjee A, Boriani G, et al. Antithrombotic Therapy for Atrial Fibrillation: CHEST Guideline and Expert Panel Report. Chest 2018;154:1121-201. [Crossref] [PubMed]
- Baluwala I, Favaloro EJ, Pasalic L. Therapeutic monitoring of unfractionated heparin - trials and tribulations. Expert Rev Hematol 2017;10:595-605. [Crossref] [PubMed]
- Favaloro EJ, Pasalic L, Curnow J, et al. Laboratory monitoring or measurement of direct oral anticoagulants (DOACs): Advantages, limitations and future challenges. Curr Drug Metab 2017;18:598-608. [Crossref] [PubMed]
- Favaloro EJ, Pasalic L, Lippi G. Replacing warfarin therapy with the newer direct oral anticoagulants, or simply a growth in anticoagulation therapy? Implications for Pathology testing. Pathology 2017;49:639-43. [Crossref] [PubMed]
- Favaloro EJ, McCaughan G, Pasalic L. Clinical and laboratory diagnosis of heparin induced thrombocytopenia: An update. Pathology 2017;49:346-55. [Crossref] [PubMed]
- Favaloro EJ, McCaughan G, Mohammed S, et al. HIT or miss? A comprehensive contemporary investigation of laboratory tests for heparin induced thrombocytopenia. Pathology 2018;50:426-36. [Crossref] [PubMed]
- Favaloro EJ. Optimizing the Verification of Mean Normal Prothrombin Time (MNPT) and International Sensitivity Index (ISI) for Accurate Conversion of Prothrombin Time (PT) to International Normalized Ratio (INR). Methods Mol Biol 2017;1646:59-74. [Crossref] [PubMed]
- Bonar R, Favaloro EJ. Explaining and reducing the variation in inter-laboratory reported values for International Normalised Ratio. Thromb Res 2017;150:22-9. [Crossref] [PubMed]
- Favaloro EJ, McVicker W, Mohammed S, et al. Mathematical rounding as a post-analytical issue in pathology reporting: generation of bias in INR resulting. Pathology 2018;50:459-61. [Crossref] [PubMed]
- Jun M, Lix LM, Durand MCanadian Network for Observational Drug Effect Studies (CNODES) Investigators, et al. Comparative safety of direct oral anticoagulants and warfarin in venous thromboembolism: multicentre, population based, observational study. BMJ 2017;359:j4323. [Crossref] [PubMed]
- Lim HY, Nandurkar H, Ho P. Direct Oral Anticoagulants and the Paradigm Shift in the Management of Venous Thromboembolism. Semin Thromb Hemost 2018;44:261-6. [Crossref] [PubMed]
- Eikelboom J, Merli G. Bleeding with direct oral anticoagulants vs warfarin: clinical experience. Am J Emerg Med 2016;34:3-8. [Crossref] [PubMed]
- Iapichino GE, Bianchi P, Ranucci M, et al. Point-of-Care Coagulation Tests Monitoring of Direct Oral Anticoagulants and Their Reversal Therapy: State of the Art. Semin Thromb Hemost 2017;43:423-32. [Crossref] [PubMed]
- Brennan Y, Favaloro EJ, Pasalic L, et al. Lessons learnt from local real-life experience with idarucizumab for the reversal of dabigatran. Intern Med J 2018; [Epub ahead of print]. [Crossref] [PubMed]
- Favaloro EJ, Mohammed S, Curnow J, et al. Laboratory testing for lupus anticoagulant (LA) in patients taking direct oral anticoagulants (DOACs): potential for false positives and false negatives. Pathology 2018; In Press.
- Favaloro EJ. Danger of false negative (exclusion) or false positive (diagnosis) for ‘congenital thrombophilia’ in the age of anticoagulants. Clin Chem Lab Med 2018; [Epub ahead of print]. [Crossref]
- Bonar R, Favaloro EJ, Mohammed S, et al. The effect of dabigatran on haemostasis tests: a comprehensive assessment using in-vitro and ex-vivo samples. Pathology 2015;47:355-64. [Crossref] [PubMed]
- Bonar R, Favaloro EJ, Mohammed S, et al. The effect of the direct factor Xa inhibitors apixaban and rivaroxaban on haemostasis tests: a comprehensive assessment using in vitro and ex vivo samples. Pathology 2016;48:60-71. [Crossref] [PubMed]
- Favaloro EJ, Lippi G. Laboratory testing in the era of direct or non-vitamin k antagonist oral anticoagulants: a practical guide to measuring their activity and avoiding diagnostic errors. Semin Thromb Hemost 2015;41:208-27. [Crossref] [PubMed]
- Gosselin RC, Adcock DM, Bates SM, et al. International Council for Standardization in Haematology (ICSH) Recommendations for Laboratory Measurement of Direct Oral Anticoagulants. Thromb Haemost 2018;118:437-50. [Crossref] [PubMed]

李洪强
医学硕士,副主任医师,自1994年7月起在中国医学科学院血液病医院(血液学研究所)血液内科工作,从事血液系统疾病的临床诊断和治疗工作二十余年,先后在门急诊、红细胞疾病、白细胞疾病、造血干细胞移植、出凝血等多个科室带组,指导住院医师、进修医师和研究生从事诊疗工作。参与的项目曾获得天津市科技进步一等奖,教育部科技进步二等奖,中国现代医院管理医疗信息化与健康医疗大数据典型案例。现为天津市病案质控委员会委员,北京市肿瘤病案信息技术专业委员会委员,中国抗癌协会肿瘤病案委员会委员,《中国医药科学》杂志审稿人。(更新时间:2021/8/31)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Favaloro EJ, McCaughan GJB, Mohammed S, Pasalic L. Anticoagulation therapy in Australia. Ann Blood 2018;3:48.