
基于齐默尔曼计划谈美国的血管性血友病
血管性血友病 (VWD) 实验室检测的现状及展望
在美国,既往通过检测血管性血友病因子(VWF)抗原(VWF:Ag)来测定VWF数量和VWF瑞斯托霉素辅因子(VWF:RCo)活性来测定血小板结合活性来诊断VWD。 然而,VWF:RCo 检测因室间重现性差[1,2]及存在某些VWF变异体错误值而影响其诊断VWD的可靠性[3]。用瑞斯托霉素诱导VWF与血小板GPIb相互作用的需求已经被最近的试验所克服,该试验利用功能增益GPIb,使其在没有瑞斯托霉素的情况下自发结合[4,5]。国际血栓及止血学会将此版本的VWF活性测定称为VWF:GPIbM,以确认使用了突变的GPIb[6]。
未来,VWF:GPIbM 可能成为 测定VWF-血小板相互作用的首选指标,但美国大多数商业实验室仍然依赖 VWF:RCo。此处介绍的VWF活性是使用以前的VWF:RCo进行的,但我们位于威斯康星州血液中心的实验室现在确实可开展VWF:GPIbM检测。临床实践各不相同,有些临床医生会选择VWF:Ag和VWF:RCo,而有些医生只会选择其中一种(如果只选一种,通常是VWF:RCo)。在某些情况下,首选进行多聚体分析,但在其他情况下,多聚体测试保留用于二线测试。一些商业实验室提供VWF胶原结合蛋白(VWF:CB),但这很少在美国以外的研究环境中进行。
我们的临床实验室试行了一种新的VWD测试方法,包括分层反射方法(图1)。考虑诊断VWD的抽取样本的一线检测包括FVIII、VWF:Ag、VWF:GPIbM和VWF胶原结合蛋白 (VWF:CB) 与3型胶原蛋白结合。如果其中任何一个异常,则根据异常情况执行特定的附加测试。如果VWF:GPIbM/VWF:Ag 或 VWF:CB/VWF:Ag比率较低,则进行多聚体分析,以研究高分子量多聚体的潜在损失。如果VWF:Ag <30 IU/dL,也进行多聚体分析,以确认多聚体分布正常,从而确定1型VWD。 如果VWF:Ag <30 IU/dL,则进行VWF前肽 (VWFpp) 检测,以评估间隙缺陷。当VWF:Ag非常低时,VWFpp也可能有助于评估可能的间隙缺陷[7]。根据一线检测结果,也可以进行VWF:血小板结合检测诊断2B型VWD[8]。如果FVIII/VWF:Ag比值较低,可以采用VWF:FVIII结合来评估2N型VWD,尽管A型血友病也可以表现为单独的FVIII下降。当怀疑 2A、2B、2M 或 2N 型时,建议对已知含有相关变异的VWF外显子进行测序。VWF全基因测序可能被推荐用于3型VWD,目的是在产前检测中确定受影响的家庭成员。表1列出了我们对VWD类型的定义以及相应的实验结果。
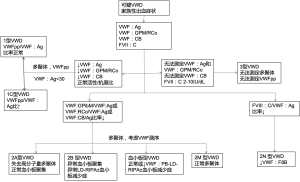
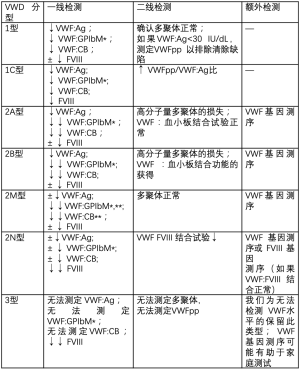
Full table
除了一般的1型VWD,识别间隙缺陷的基本原理是,在这些情况下,对处理的反应可能不同。VWF间隙缺陷,以维琴察变体为代表,但包括其他N端和C末端VWF变体,表现出对去氨加压素的非常短暂的高反应性[7,9]。因此,当出现VWF水平的持续升高时,临床医生治疗时不应使用去氨加压素。
将多聚体检测排除在第一线检测之外可以更快、更有效地获得结果,而需要更多人力的多聚体检测仅对一部分样本进行。然而,一些临床医生仍然建议将多聚体分析作为一线检测,因为有可能无法检测到仍表现为正常VWF活性的多聚体缺陷。这已经在一些心脏瓣膜缺陷病例中看到,并且在这些情况下可能与临床上的出血有关。
值得注意的是,1型VWD诊断的正式确诊值仍然是一个具有争议的话题[10]。轻度出血症状很常见,因此患者可能会同时出现低VWF和轻度出血。O型血患者的VWF水平通常低于其他血型的患者,因此低于正常参考区间的VWF水平并不一定保证存在有症状的 VWD[11]。一些研究组建议将1型VWD的临界值设为30 IU/dL[12,13]。然而,由于临近低VWF 水平可能是出血的危险因素,我们考虑对任何出血和低VWF水平的患者进行治疗。
美国各地的VWD
美国的一些关于VWD的数据可以从齐默尔曼计划的VWD分子和临床生物学(Zimmerman计划)获得。迄今为止,齐默尔曼项目已经收录了256名健康对照受试者和741名VWD受试者。该研究旨在从亚特兰大、底特律、休斯顿、印第安纳波利斯、爱荷华、密尔沃基、新奥尔良和匹兹堡的一级收录中心对美国各地的VWD进行抽样调查(完整的调查人员名单请参见附录部分)。一些二级收录中心也为本项目做出了贡献,已被列在附录。所有受试者都是根据预先诊断的VWD入组的。表2显示了Zimmerman计划受试者基于VWD诊断的人口统计数据。表3显示了本中心目前随访的各类型VWD患者的百分比。
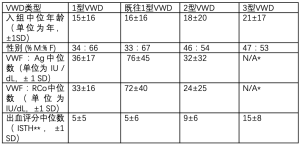
Full table

Full table
这项研究的一个特别结果是有VWD病史且在进入研究时,实验室检测正常的受试者数量。在诊断为1型VWD的初始组中,只有64%的受试者在进入研究时具有低VWF水平[14]。 其余36%的受试者VWD检验完全正常,然而这些受试者的出血评分与确认为低VWF水平的受试者相似(图2)。
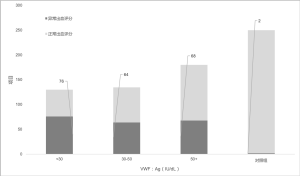
对此有几种可能的解释:一是VWF水平随着年龄的增长而增加,这样相对轻微的VWF缺陷可以随着时间的推移而解决;另一个原因是老年患者可能同时发生炎症,导致VWF升高到正常范围。然而,第三种可能性是一些患者根据低于正常人群参考区间的单一实验室值被诊断为VWD,希望可以对出现出血症状的患者进行诊断。
最后一种假设在已有数据的受试者中得到了一定证实。在172例入组实验室检测正常的1型VWD患者中,26%的患者仅存在VWF:RCo低,而VWF:Ag正常。在剩下的受试者中,10%的人仅有VWF:Ag降低, 37%的人VWF:Ag和VWF:RCo都降低,剩下的受试者仅显示正常的VWF水平记录。在这些受试者中,人们猜测最初临床医生面对一个病人出现出血症状(并可能对去氨加压素反应良好),最终会诊断为1型VWD。但在进一步复检正常的情况下,原患者出血的主要原因可能是轻度血小板功能缺陷、其他凝血问题或合并缺陷,而不是真正受VWD或低VWF影响。
有一些受试者在重复试验时存在已知的合并症(妊娠、风湿病),其初始诊断VWF水平可能不准确,还有一些受试者没有既往数据。现在电子病历已经常规应用,以后的病人很可能不会有这个问题,但对于一些年龄较大的入组受试者来说,很难找到他们最初的实验室检测结果。以往在冷冻条件下采样检测被证明可以降低血浆中的VWF水平,现已不被推荐[15,16]。由于齐默尔曼项目的受试者也将被前瞻性跟踪,我们希望能够以一种更前瞻性的方式解决与年龄相关的VWF水平增加的问题,这也有助于解决VWF水平上升快的问题,因为大量1型VWD受试者都处于儿童年龄段。
另一个相关问题是,即使在VWF轻微减少的受试者中,出血主诉的频率也很高。图 2 显示了与齐默尔曼项目的健康对照组相比,1型VWD受试者的出血评分。与对照组相比,VWF:Ag <30 IU/dL 的受试者的出血评分中位数略高,而VWF:Ag 30–50 IU/dL的受试者则显著出血。这可能与诊断的方式有关,出血患者先接受处理,然后诊断为VWD。可能偶尔会有基于家族史或异常实验室检查诊断出的儿科患者,他们没有个人出血史,但一般来说,检查和诊断源于最初的出血主诉。我们的出血评分数据只是反映了出血导致出血。 Federici及其同事更明确的证明,其在意大利VWD受试者的数据表明出血评分增加是未来出血的风险[17]。
VWD的治疗
我们中心对VWD的典型治疗方案包括VWD特异性治疗和辅助治疗。如需要,抗纤维蛋白溶解剂可以用于手术预防或有症状的出血,包括鼻衄和大量月经出血。我们也会尽可能与我们的妇科同事一起探索针对大量月经出血的激素疗法。
在某些情况下,VWD需要特异性治疗方法。我们大多数的1型患者对去氨加压素反应良好,使其可用于手术预防和出血治疗。我们通常会先进行试验,因为并非所有患者都有反应,有些患者可能存在清除缺陷。如上所述,在实验室检测中,有清除缺陷的患者可能最初对去氨加压素的实验室检测反应良好,但内源性VWF的快速清除阻止了去氨加压素作为手术或大出血的充分治疗。因此,如果怀疑存在清除缺陷,重要的不仅仅是依赖去氨加压素后1小时的反应,而是获得延迟效果。在2B型中检测和使用去氨加压素是有争议的,但一些2A和2M型患者会通过使用去氨加压素获得症状的缓解。
对于2型或3型VWD,或1型VWD对去氨加压素反应不足的患者,VWF浓缩物是首选治疗方法。去年之前,只有血浆衍生的浓缩物可用,而Wilate(野生型)和Humate-P(精制灭菌冻干人抗血友病因子)是美国使用最多的。然而,最近批准的重组VWF表明可能在未来得到更多的应用[18]。
总结和结论
在美国,VWD的诊断仍然是一项复杂的任务,没有独特而简单的诊断试验可用,但用单个血液标本诊断VWD特定类型的反射检测策略将压力放在了在检验医师身上而不是开单的临床医师(图1)。然而仍有许多亟待解决的问题,包括低VWF受试者的难题,以及VWF水平随年龄增长的可能性,但希望进一步的研究将使我们能够准确区分哪些患者需要治疗并改善各地 VWD患者的治疗效果。
Acknowledgments
Funding: This work was funded by the National Heart, Lung, and Blood Institute of the National Institutes of Health, grants HL081588, HL102260 and HL126810, and by the MACC Fund Center for Cancer and Blood Disorders.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Emmanuel J. Favaloro) for the series “Diagnosis and Management of von Willebrand Disease: Diverse Approaches to a Global and Common Bleeding Disorder” published in Annals of Blood. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aob.2017.12.05). The series “Diagnosis and Management of von Willebrand Disease: Diverse Approaches to a Global and Common Bleeding Disorder” was commissioned by the editorial office without any funding or sponsorship. VHF has served as a consultant for CSL Behring and Shire. KDF has served as a consultant for Bayer, CSL Behring, Genentech, NovoNordisk, and Shire, and as a speaker for Alexion. RRM has a patent for a VWF:GPIbM assay that is used by the Blood Center of Wisconsin. The remaining authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the manuscript and ensure that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Kitchen S, Jennings I, Woods TA, et al. Laboratory tests for measurement of von Willebrand factor show poor agreement among different centers: results from the United Kingdom National External Quality Assessment Scheme for Blood Coagulation. Semin Thromb Hemost 2006;32:492-8. [Crossref] [PubMed]
- Meijer P, Haverkate F. An external quality assessment program for von Willebrand factor laboratory analysis: an overview from the European concerted action on thrombosis and disabilities foundation. Semin Thromb Hemost 2006;32:485-91. [Crossref] [PubMed]
- Flood VH, Gill JC, Morateck PA, et al. Common VWF exon 28 polymorphisms in African Americans affecting the VWF activity assay by ristocetin cofactor. Blood 2010;116:280-6. [Crossref] [PubMed]
- Flood VH, Gill JC, Morateck PA, et al. Gain-of-function GPIb ELISA assay for VWF activity in the Zimmerman Program for the Molecular and Clinical Biology of VWD. Blood 2011;117:e67-74. [Crossref] [PubMed]
- Patzke J, Budde U, Huber A, et al. Performance evaluation and multicentre study of a von Willebrand factor activity assay based on GPIb binding in the absence of ristocetin. Blood Coagul Fibrinolysis 2014;25:860-70. [Crossref] [PubMed]
- Bodó I, Eikenboom J, Montgomery R, et al. Platelet-dependent von Willebrand factor activity. Nomenclature and methodology: communication from the SSC of the ISTH. J Thromb Haemost 2015;13:1345-50. [Crossref] [PubMed]
- Haberichter SL, Balistreri M, Christopherson P, et al. Assay of the von Willebrand factor (VWF) propeptide to identify patients with type 1 von Willebrand disease with decreased VWF survival. Blood 2006;108:3344-51. [Crossref] [PubMed]
- Scott JP, Montgomery RR. The rapid differentiation of type IIb von Willebrand’s disease from platelet-type (pseudo-) von Willebrand's disease by the “neutral” monoclonal antibody binding assay. Am J Clin Pathol 1991;96:723-8. [Crossref] [PubMed]
- Casonato A, Pontara E, Sartorello F, et al. Reduced von Willebrand factor survival in type Vicenza von Willebrand disease. Blood 2002;99:180-4. [Crossref] [PubMed]
- Sadler JE. Von Willebrand disease type 1: a diagnosis in search of a disease. Blood 2003;101:2089-93. [Crossref] [PubMed]
- Gill JC, Endres-Brooks J, Bauer PJ, et al. The effect of ABO blood group on the diagnosis of von Willebrand disease. Blood 1987;69:1691-5. [PubMed]
- Nichols WL, Hultin MB, James AH, et al. von Willebrand disease (VWD): evidence-based diagnosis and management guidelines, the National Heart, Lung, and Blood Institute (NHLBI) Expert Panel report (USA). Haemophilia 2008;14:171-232. [Crossref] [PubMed]
- Laffan MA, Lester W, O’Donnell JS, et al. The diagnosis and management of von Willebrand disease: a United Kingdom Haemophilia Centre Doctors Organization guideline approved by the British Committee for Standards in Haematology. Br J Haematol 2014;167:453-65. [Crossref] [PubMed]
- Flood VH, Christopherson PA, Gill JC, et al. Clinical and laboratory variability in a cohort of patients diagnosed with type 1 VWD in the United States. Blood 2016;127:2481-8. [Crossref] [PubMed]
- Favaloro EJ. Laboratory identification of von Willebrand disease: technical and scientific perspectives. Semin Thromb Hemost 2006;32:456-71. [Crossref] [PubMed]
- Lipton RA. Misdiagnosis by milk box. Haemophilia 2003;9:235. [Crossref] [PubMed]
- Federici AB, Bucciarelli P, Castaman G, et al. The bleeding score predicts clinical outcomes and replacement therapy in adults with von Willebrand disease. Blood 2014;123:4037-44. [Crossref] [PubMed]
- Gill JC, Castaman G, Windyga J, et al. Hemostatic efficacy, safety, and pharmacokinetics of a recombinant von Willebrand factor in severe von Willebrand disease. Blood 2015;126:2038-46. [Crossref] [PubMed]

连俊慧
毕业于内科学血液学专业,并于毕业后从事临床输血专业,目前共撰写国家级期刊论文三篇,核心期刊论文一篇,核心期刊论文翻译稿两篇,协助完成科室论文两篇,并负责科室科研教学工作。(更新时间:2021/8/31)

李洪强
医学硕士,副主任医师,自1994年7月起在中国医学科学院血液病医院(血液学研究所)血液内科工作,从事血液系统疾病的临床诊断和治疗工作二十余年,先后在门急诊、红细胞疾病、白细胞疾病、造血干细胞移植、出凝血等多个科室带组,指导住院医师、进修医师和研究生从事诊疗工作。参与的项目曾获得天津市科技进步一等奖,教育部科技进步二等奖,中国现代医院管理医疗信息化与健康医疗大数据典型案例。现为天津市病案质控委员会委员,北京市肿瘤病案信息技术专业委员会委员,中国抗癌协会肿瘤病案委员会委员,《中国医药科学》杂志审稿人。(更新时间:2021/8/31)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Flood VH, Abshire TC, Christopherson PA, Friedman KD, Gill JC, Montgomery RR, Haberichter SL; the Zimmerman Program Investigators. Von Willebrand disease in the United States: perspective from the Zimmerman program. Ann Blood 2018;3:7.


